A tabela periódica de elementos é uma tabela que contém todos os elementos químicos conhecidos representados.
Durante o século 19, os químicos começaram a classificar os elementos químicos conhecidos de acordo com suas propriedades físicas e químicas. Em 1860, o primeiro Congresso Internacional de Químicos foi organizado na cidade alemã de Karlsruhe com o objetivo de unificar os critérios de classificação dos elementos. Esse encontro foi crucial na história da ciência e na origem da criação da mesa que hoje aparece nos livros didáticos.
De acordo com a União Internacional de Química Pura e Aplicada (IUPAC), a tabela periódica dos elementos químicos nasceu em 1º de março de 1869.
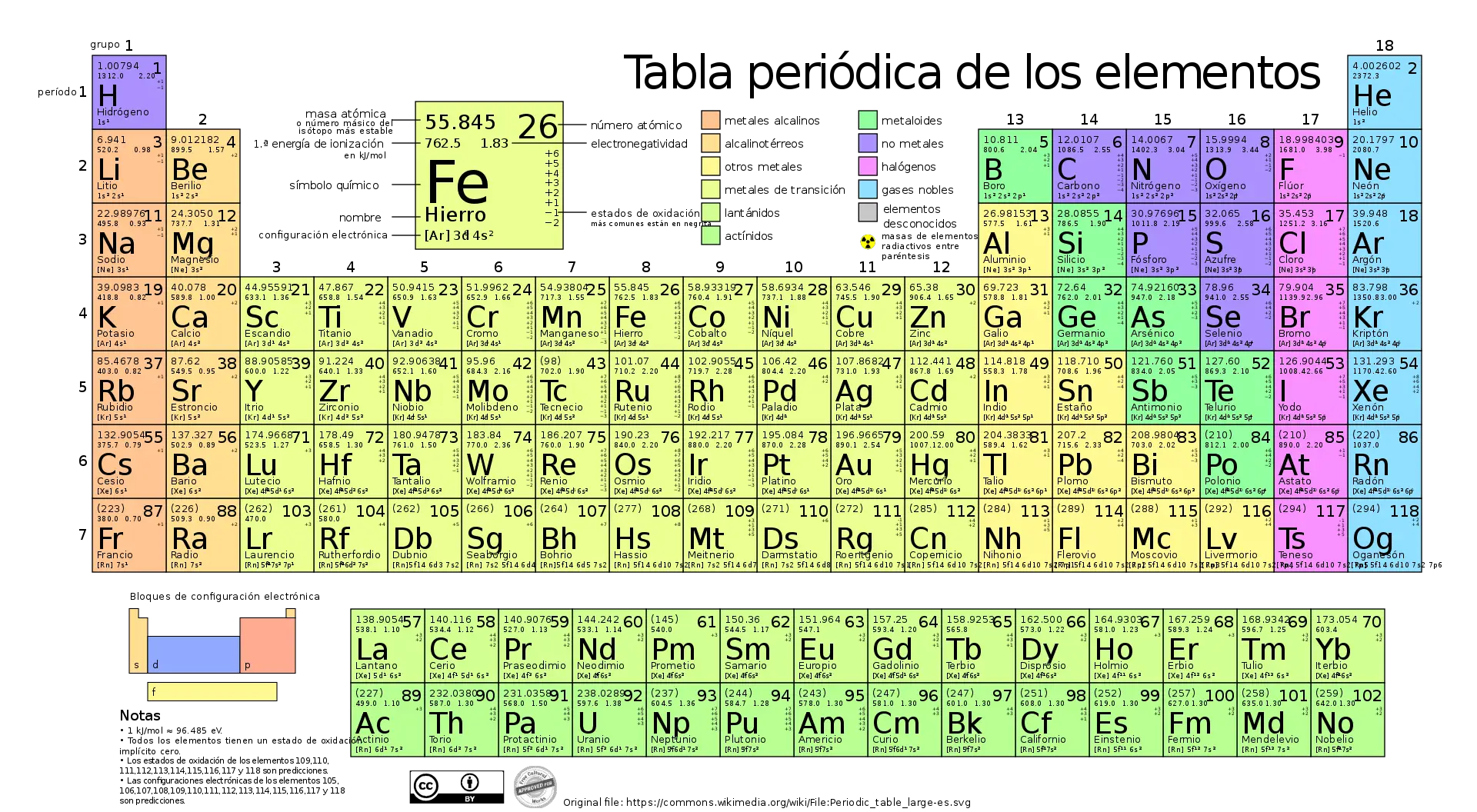
Quantos elementos químicos a tabela periódica contém?
Atualmente a tabela periódica contém 118 elementos químicos.
Os últimos elementos introduzidos na tabela periódica são os elementos 113, 115, 117 e 118. Os nomes desses novos elementos são Nihonium, Moscovio, Teneso e Oganesón, respectivamente. Essa incorporação ocorreu em 1º de dezembro de 2016.
Como os elementos químicos são organizados na tabela periódica?
Na tabela periódica, os elementos químicos são ordenados de acordo com seus números atômicos, ou seja, o número de prótons no núcleo do átomo.
A tabela periódica é organizada em linhas e colunas. As colunas são chamadas de grupos, enquanto as linhas são conhecidas como períodos.
Os elementos são dispostos de forma que elementos com configurações eletrônicas semelhantes fiquem em cima uns dos outros. Também é ordenado de forma que os itens com comportamentos semelhantes fiquem na mesma coluna.
Para que serve a tabela periódica?
A tabela periódica tem vários usos em química e outras ciências. Os mais importantes são:
-
Mostre as relações entre os diferentes elementos químicos.
-
Preveja as propriedades de elementos que acabaram de ser descobertos ou que ainda não foram sintetizados.
-
Fornece uma imagem útil ao analisar o comportamento químico de produtos químicos.
Período na tabela periódica
Um período na tabela periódica corresponde a uma linha horizontal. Normalmente, as tendências periódicas mais claras são vistas nos grupos, no entanto, existem certas regiões da tabela em que as tendências na direção horizontal são mais proeminentes.
Os elementos do mesmo período na tabela mostram tendências no potencial de ionização, raio atômico e afinidade eletrônica e eletronegatividade.
Da esquerda para a direita em um período, o raio atômico geralmente diminui. Isso ocorre porque, nessa direção, cada elemento da tabela tem um elétron e um próton extras, e os elétrons se aproximam do núcleo. Essa diminuição no raio atômico garante que, ao longo de um período de tempo, o potencial de ionização também aumentará da esquerda para a direita.
A eletronegatividade aumenta, assim como o potencial de ionização. Esse aumento se deve ao fato de o núcleo atrair elétrons.
Grupos ou famílias da tabela periódica
Um grupo ou família é uma coluna na tabela periódica de elementos químicos. Normalmente, os grupos têm tendências periódicas mais proeminentes do que blocos e períodos.
Os elementos químicos que pertencem ao mesmo grupo têm propriedades químicas semelhantes. Além disso, há uma tendência clara de aumentar o número atômico. Mas, em algumas partes da tabela, as semelhanças horizontais e verticais podem ser tão importantes.
Propriedades dos elementos dentro do grupo
Elementos no mesmo grupo tendem a exibir padrões de raio atômico, potencial de ionização e eletronegatividade. De cima para baixo, o raio atômico dos elementos aumentará por grupo, à medida que houver mais elétrons e os elétrons de valência ficarão mais distantes do núcleo do átomo.
De cima para baixo, cada elemento químico tem um potencial de ionização mais fraco. Isso ocorre porque é mais fácil remover um elétron e a força com a qual os átomos estão ligados é mais fraca.
A eletronegatividade das famílias geralmente diminui à medida que você desce na tabela. Essa diminuição se deve ao aumento da distância entre o núcleo e os elétrons de valência.
Blocos da tabela periódica
Os blocos são as regiões específicas da tabela periódica dos elementos. O nome do bloco corresponde ao da camada que contém o último elétron.
Na tabela periódica existem os seguintes blocos:
-
O bloco “s”: inclui o primeiro e o segundo grupos que correspondem a hidrogênio, hélio, metais alcalinos e metais alcalino-terrosos.
-
O bloco "p" inclui os últimos seis grupos. Entre outros elementos, inclui gases nobres e metaloides.
-
O bloco "d" inclui grupos entre 3 e 12. Este bloco contém todos os metais de transição.
-
O bloco "f" não possui números de grupo. Geralmente é representado abaixo do resto da tabela. O "f" bloqueia os actinídeos e lantanídeos.
Quem é creditado com a tabela periódica?
A primeira tabela periódica reconhecível foi publicada pelo químico russo Dmitri Mendeleev em 1869 em uma obra chamada "Princípios de Química". A forma como organizamos os elementos químicos hoje ainda segue a proposta de Mendeleev.
 Ao mesmo tempo, o químico alemão Julius Lothar Meyer, concorrente contemporâneo de Mendeleev, também trabalhou com a ideia de criar a primeira tabela periódica. Meyer ordenou os elementos com base nas propriedades físicas dos átomos, mas sua proposta não era tão popular.
Ao mesmo tempo, o químico alemão Julius Lothar Meyer, concorrente contemporâneo de Mendeleev, também trabalhou com a ideia de criar a primeira tabela periódica. Meyer ordenou os elementos com base nas propriedades físicas dos átomos, mas sua proposta não era tão popular.
Desde o seu início, a tabela periódica de elementos de Mendeleev foi completada e expandida à medida que outros elementos foram descobertos ou sintetizados.
No entanto, alguns cientistas acreditam que a versão final da tabela foi alcançada graças à lei periódica apresentada no início do século 20 por Henry Moseley.
As previsões de Dmitri Mendeleev
Mendeleev desenvolveu sua tabela para mostrar as tendências periódicas dos 63 elementos químicos conhecidos na época. Ele também previu algumas propriedades de produtos químicos que eram desconhecidos na época, mas que esperava preencher as lacunas da tabela.
Quando esses novos elementos foram descobertos, suas previsões se revelaram amplamente corretas.
