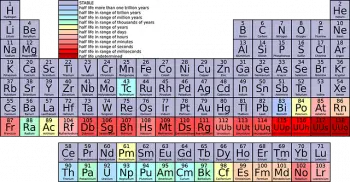
A tabela periódica dos elementos químicos é uma das ferramentas mais poderosas e essenciais da química e da ciência em geral. Entre suas características mais distintivas estão as “famílias” ou “grupos” nos quais os elementos químicos são organizados de acordo com suas propriedades semelhantes.
Antes de mergulharmos nas famílias específicas da tabela periódica, é importante compreender a sua organização geral:
Quais são as famílias da tabela periódica?
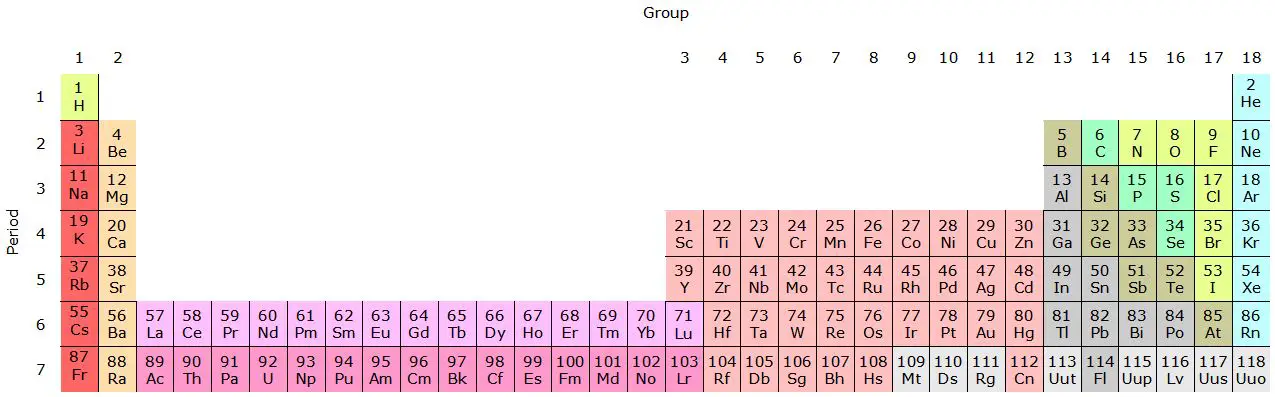 As famílias na tabela periódica são grupos verticais de elementos com propriedades químicas semelhantes devido à sua configuração eletrônica compartilhada na camada eletrônica mais externa.
As famílias na tabela periódica são grupos verticais de elementos com propriedades químicas semelhantes devido à sua configuração eletrônica compartilhada na camada eletrônica mais externa.
A tabela periódica é dividida em linhas horizontais chamadas “períodos” e colunas verticais chamadas “grupos” ou “famílias”. Os elementos estão organizados em ordem crescente de número atômico, que é o número de prótons no núcleo de um átomo.
Os elementos de cada família compartilham características e propriedades químicas semelhantes. Cada família possui um número específico e é identificada com um algarismo romano ou um número ordinal (por exemplo, Grupo I ou Grupo 1).
Por que os elementos são organizados em famílias?
Na década de 1860, Dmitri Mendeleev tentava organizar os elementos conhecidos com base em suas propriedades e massas atômicas.
Durante esse processo, ele percebeu que quando os elementos eram dispostos em fileiras em ordem crescente de suas massas atômicas, eram produzidos padrões repetitivos de propriedades químicas semelhantes a cada determinado número de elementos.
Isso o levou à ideia de que os elementos deveriam ser organizados em colunas ou famílias, onde os elementos da mesma coluna teriam propriedades químicas semelhantes.
As famílias mais importantes da tabela periódica
Família 1: Metais alcalinos
 Os metais alcalinos são os elementos do grupo 1 da tabela periódica, que inclui hidrogênio (H), lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr).
Os metais alcalinos são os elementos do grupo 1 da tabela periódica, que inclui hidrogênio (H), lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr).
Propriedades básicas
Esses elementos são altamente reativos e tendem a perder um elétron para formar íons positivos. Eles são conhecidos por sua capacidade de reagir vigorosamente com a água e produzir gás hidrogênio.
Uso e aplicações
Os metais alcalinos encontram aplicações em diversas áreas, desde baterias de íon-lítio em dispositivos eletrônicos até a fabricação de vidro e a síntese de compostos químicos.
Família 2: Metais alcalino-terrosos
A família dos metais alcalino-terrosos compreende os elementos do grupo 2 da tabela periódica, que inclui berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e raio (Ra).
Propriedades básicas
Esses elementos também são metais, mas são menos reativos que os metais alcalinos. Eles têm dois elétrons em sua camada mais externa e tendem a perder esses dois elétrons em reações químicas.
Uso e aplicações
Os metais alcalino-terrosos são essenciais para a estrutura dos ossos e dentes (cálcio), para a fabricação de ligas metálicas (magnésio) e para a tecnologia nuclear (rádio).
Família 17: Halogênios
 Os halogênios formam a família 17 da tabela periódica e incluem flúor (F), cloro (Cl), bromo (Br), iodo (I) e astato (At).
Os halogênios formam a família 17 da tabela periódica e incluem flúor (F), cloro (Cl), bromo (Br), iodo (I) e astato (At).
Propriedades básicas
Esses elementos são altamente reativos e tendem a ganhar um elétron para formar íons negativos. Eles são conhecidos por sua capacidade de formar compostos iônicos com metais alcalinos e alcalino-terrosos.
Uso e aplicações
Os halogênios encontram aplicações na desinfecção de água (cloro), na fabricação de produtos farmacêuticos (iodo) e na fotografia (brometo de prata).
Família 18: Gases nobres
A família dos gases nobres, também conhecidos como gases inertes, inclui hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn).
Propriedades básicas
Esses elementos são conhecidos por sua baixa reatividade química porque possuem uma camada eletrônica completamente preenchida.
Uso e aplicações
Essa estabilidade torna os gases nobres úteis em aplicações como lâmpadas de néon, refrigeração criogênica e luzes de sinalização.
Família de lantanídeos e actinídeos
Na parte inferior da tabela periódica, encontramos duas séries de elementos conhecidos como lantanídeos e actinídeos. Os lantanídeos são elementos do bloco f, enquanto os actinídeos são elementos do bloco f.
Os lantanídeos e actinídeos são duas séries de elementos localizados na parte inferior da tabela periódica e são frequentemente excluídos da numeração típica de grupo ou família da tabela principal. Essas séries são conhecidas como "séries internas" ou "séries f". Estas séries de elementos são frequentemente chamadas de “terras raras” devido à sua relativa raridade na crosta terrestre.
Embora os lantanídeos e os actinídeos não sejam tradicionalmente numerados como grupos na tabela periódica, às vezes são atribuídos algarismos romanos ou referidos como "Grupo 3" para os lantanídeos e "Grupo 4" para os actinídeos como uma forma simplificada de se referir a eles.
Uso e aplicações
Os lantanídeos são utilizados na fabricação de ímãs poderosos, catalisadores químicos e na indústria eletrônica. Por outro lado, os actinídeos, incluindo elementos como o urânio e o plutônio, são de grande importância na tecnologia nuclear e na geração de energia.
Outras famílias
Além das famílias citadas acima, existem outros grupos de elementos da tabela periódica com características e propriedades únicas.
Por exemplo, o grupo 3 contém os “lantanídeos leves” e o grupo 16 contém os “calcógenos”, que incluem oxigênio, enxofre e selênio.
