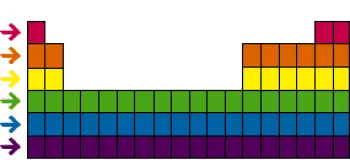
A tabela periódica dos elementos é uma das ferramentas mais poderosas e fundamentais da química. Além de famílias ou grupos , a tabela periódica também é organizada em “períodos” ou “linhas” horizontais.
Os períodos têm importância significativa na compreensão da química dos elementos, pois representam um arranjo ordenado de elétrons nas camadas eletrônicas dos átomos.
A estrutura de um período
Cada período da tabela periódica representa uma camada eletrônica adicional nos átomos dos elementos à medida que avançamos da esquerda para a direita na tabela. A partir do primeiro período no topo, que contém apenas dois elementos (hidrogênio e hélio), os elementos de cada período possuem o mesmo número de camadas eletrônicas.
Exemplos
Por exemplo, no segundo período, elementos como lítio, berílio, boro, carbono, nitrogênio, oxigênio, flúor e néon têm todos duas camadas eletrônicas em seus átomos.
No terceiro período, elementos como sódio, magnésio, alumínio, silício, fósforo, enxofre, cloro e argônio possuem três camadas eletrônicas, e assim por diante, à medida que avançamos para períodos inferiores.
Propriedades dos elementos de um período
Os elementos do mesmo período possuem propriedades químicas e físicas que seguem certos padrões e tendências:
tamanho atômico

Isso ocorre porque à medida que prótons e elétrons são adicionados à mesma camada eletrônica, a carga nuclear efetiva aumenta, o que atrai os elétrons com mais força em direção ao núcleo, reduzindo o tamanho do átomo.
Eletro-negatividade
A eletronegatividade, que mede a tendência de um átomo de atrair elétrons compartilhados em uma ligação química, tende a aumentar à medida que vamos da esquerda para a direita em um período.
Os elementos do lado direito de um período são mais eletronegativos do que os do lado esquerdo.
Reatividade
Elementos na mesma coluna da tabela periódica (no mesmo grupo ou família) tendem a ter propriedades químicas semelhantes porque possuem o mesmo número de elétrons em sua camada de valência.
No entanto, ao longo de um período, à medida que avançamos da esquerda para a direita, os elementos tendem a tornar-se menos metálicos e mais não metálicos no seu comportamento químico.
Por exemplo, os metais alcalinos do Grupo 1 são altamente reativos, enquanto os elementos do lado direito de um período, como o flúor e o oxigênio, são não-metais e tendem a formar compostos covalentes.
Energia de ionização
A energia de ionização, que é a energia necessária para remover um elétron de um átomo, geralmente aumenta à medida que vamos da esquerda para a direita em um período.
Os elementos do lado direito de um período têm energias de ionização mais altas, o que significa que é mais difícil remover um elétron de seus átomos.
Importância dos períodos
 Os períodos da tabela periódica são fundamentais para compreender como a estrutura eletrônica dos átomos influencia seu comportamento químico. Ao observar tendências nas propriedades dos elementos ao longo de um período, os químicos podem prever como os átomos irão interagir e formar compostos químicos.
Os períodos da tabela periódica são fundamentais para compreender como a estrutura eletrônica dos átomos influencia seu comportamento químico. Ao observar tendências nas propriedades dos elementos ao longo de um período, os químicos podem prever como os átomos irão interagir e formar compostos químicos.
Além disso, as informações do período também são valiosas na química inorgânica e na síntese de compostos.
Por exemplo, ao tentar sintetizar um novo composto químico, conhecer as propriedades dos elementos durante o mesmo período pode ajudar os cientistas a selecionar os elementos apropriados para reagir da maneira desejada.
Conclusão
Os períodos da tabela periódica são parte essencial da sua organização e desempenham um papel crucial na compreensão da química dos elementos.
À medida que avançamos da esquerda para a direita num período, podemos observar como as propriedades e o comportamento dos elementos mudam sistematicamente devido à adição de camadas eletrônicas e à variação na carga nuclear efetiva.
Esta organização ordenada dos elementos em períodos é um lembrete da profunda relação entre a estrutura electrónica dos átomos e a sua química subjacente.
