Massa molar é uma propriedade física usada para descrever a massa média de um átomo ou molécula de uma substância em unidades de gramas por mol (g/mol) e é representada pela letra “M”.
Em outras palavras, a massa molar indica quantos gramas de uma substância existem em um mol dessa substância. A toupeira é uma unidade de quantidade de substância no Sistema Internacional de Unidades (SI).
Unidades de medida
No Sistema Internacional de Unidades (SI), a unidade para medir a massa molar é quilograma por mol (kg/mol). Porém, quando a massa molar é expressa em g/mol, seu valor numérico é igual ao peso molecular relativo. Por esta razão, historicamente o peso molar é geralmente expresso em gramas por mol (g/mol).
A massa molar nas fórmulas é geralmente indicada por uma letra maiúscula M.
Comparações diretas e medições das massas de átomos e moléculas são feitas usando métodos de espectrometria de massa.
Cálculo da massa molar
O cálculo da massa molar de um composto é feito somando as massas de todos os átomos de uma molécula usando as massas atômicas relativas.
Massas atômicas relativas são números que representam a massa de um átomo em relação à massa do átomo de carbono-12, que é definido como 12 unidades de massa atômica (amu).
Por exemplo, a massa atômica relativa do hidrogênio é de aproximadamente 1 u, enquanto a massa atômica relativa do oxigênio é de aproximadamente 16 u.
Moléculas complexas
 Para calcular o número de massas molares de moléculas complexas, ele pode ser determinado somando as massas molares de seus elementos constituintes. Por exemplo, a massa molar da água H 2 O é
Para calcular o número de massas molares de moléculas complexas, ele pode ser determinado somando as massas molares de seus elementos constituintes. Por exemplo, a massa molar da água H 2 O é
M(H2O ) = 2 M(H) + M(O) = 2,1 g/mol + 16 g/mol = 18,1 g/mol
Como calcular a massa molar passo a passo?
O cálculo da massa molar de uma substância química pode ser feito seguindo estas etapas:
-
Identifique a fórmula química do composto químico.
-
Determine quantos átomos de cada elemento existem na fórmula química.
-
Multiplique o número de átomos de cada elemento pela sua massa atômica relativa.
-
Adicione as massas de todos os átomos da fórmula para obter a massa molar.
Exemplo prático
Vejamos um exemplo concreto para calcular a massa molar da água (H₂O):
-
A fórmula química da água é H₂O, o que significa que ela contém dois átomos de hidrogênio (H) e um átomo de oxigênio (O).
-
A massa atômica relativa do hidrogênio é de aproximadamente 1 u e a do oxigênio é de aproximadamente 16 u.
-
Para calcular a massa molar da água, somamos as massas dos átomos: (2 * 1 amu) + (1 * 16 amu) = 2 amu + 16 amu = 18 amu.
Portanto, a massa molar da água é 18 g/mol.
Exemplos
Abaixo está uma tabela com exemplos de algumas massas molares de diferentes substâncias:
|
substância |
Fórmula química |
Massa molar (g/mol) |
Descrição |
|
Hidrogênio |
H₂ |
2 |
O hidrogênio é o elemento mais leve, com massa molar de 2 g/mol. |
|
Oxigênio |
O₂ |
32 |
O oxigênio é essencial para a respiração e tem massa molar de 32 g/mol. |
|
Dióxido de carbono |
CO₂ |
44 |
CO₂ é um gás de efeito estufa com massa molar de 44 g/mol. |
|
Amônia |
NH₃ |
17 |
A amônia é utilizada na indústria química e tem massa molar de 17 g/mol. |
|
Metano |
CH₄ |
16 |
O metano é o principal componente do gás natural e tem massa molar de 16 g/mol. |
|
Ácido sulfúrico |
H₂SO₄ |
98 |
O ácido sulfúrico é um ácido forte amplamente utilizado com massa molar de 98 g/mol. |
|
Glicose |
C₆H₁₂O₆ |
180 |
A glicose é um açúcar encontrado nos alimentos e tem massa molar de 180 g/mol. |
|
Cloreto de Sódio (sal de cozinha) |
NaCl |
58,5 |
O cloreto de sódio é um sal de cozinha comum e tem massa molar de 58,5 g/mol. |
|
Urânio |
OU |
238.03 |
O urânio é um elemento utilizado como combustível em reatores nucleares. |
|
Plutônio |
Pu |
244 |
O plutônio é um elemento usado em armas nucleares e reatores nucleares. |
|
Água pesada |
D₂O |
20.03 |
A água pesada contém deutério em vez de hidrogênio e é usada em reatores nucleares. |
|
Urânio enriquecido |
U-235 |
Varia |
O urânio enriquecido contém uma proporção maior de U-235 e é essencial para a fissão nuclear. |
Para que é usada a massa molar?
A massa molar é uma propriedade fundamental que tem diversas implicações e aplicações em química e outras disciplinas científicas.
Algumas de suas aplicações mais notáveis incluem:
-
Conversão entre moles e gramas: usada para converter entre a quantidade de substância em moles e a massa em gramas de uma substância.
-
Determinação da composição de substâncias.
-
Cálculo de reações químicas: É essencial para o cálculo das quantidades de reagentes e produtos em uma reação química, permitindo a estequiometria e o planejamento de experimentos.
-
Identificação de substâncias desconhecidas: Utilizado em técnicas analíticas, como espectroscopia de massa, para identificar substâncias desconhecidas através da comparação de suas massas molares experimentais com massas molares calculadas.
-
Aplicações em termodinâmica: na termodinâmica química é utilizado para calcular propriedades como entalpia e entropia de reações químicas.
Importância da vida cotidiana
A massa molar não é importante apenas no laboratório, mas também tem aplicações na vida cotidiana. Alguns exemplos incluem:
-
Nutrição : Na indústria alimentícia é utilizado para calcular a quantidade de nutrientes dos alimentos e estabelecer recomendações diárias de consumo de nutrientes essenciais como proteínas, carboidratos e gorduras.
-
Farmacologia : Na formulação de medicamentos, é fundamental conhecer a massa molar dos componentes ativos e excipientes para garantir a dosagem adequada e eficácia do medicamento.
-
Energia : Na indústria de energia, a massa molar é utilizada na produção e utilização de combustíveis e energias renováveis, como no cálculo da densidade do combustível e na eficiência da célula de combustível.
Relação com a tabela periódica
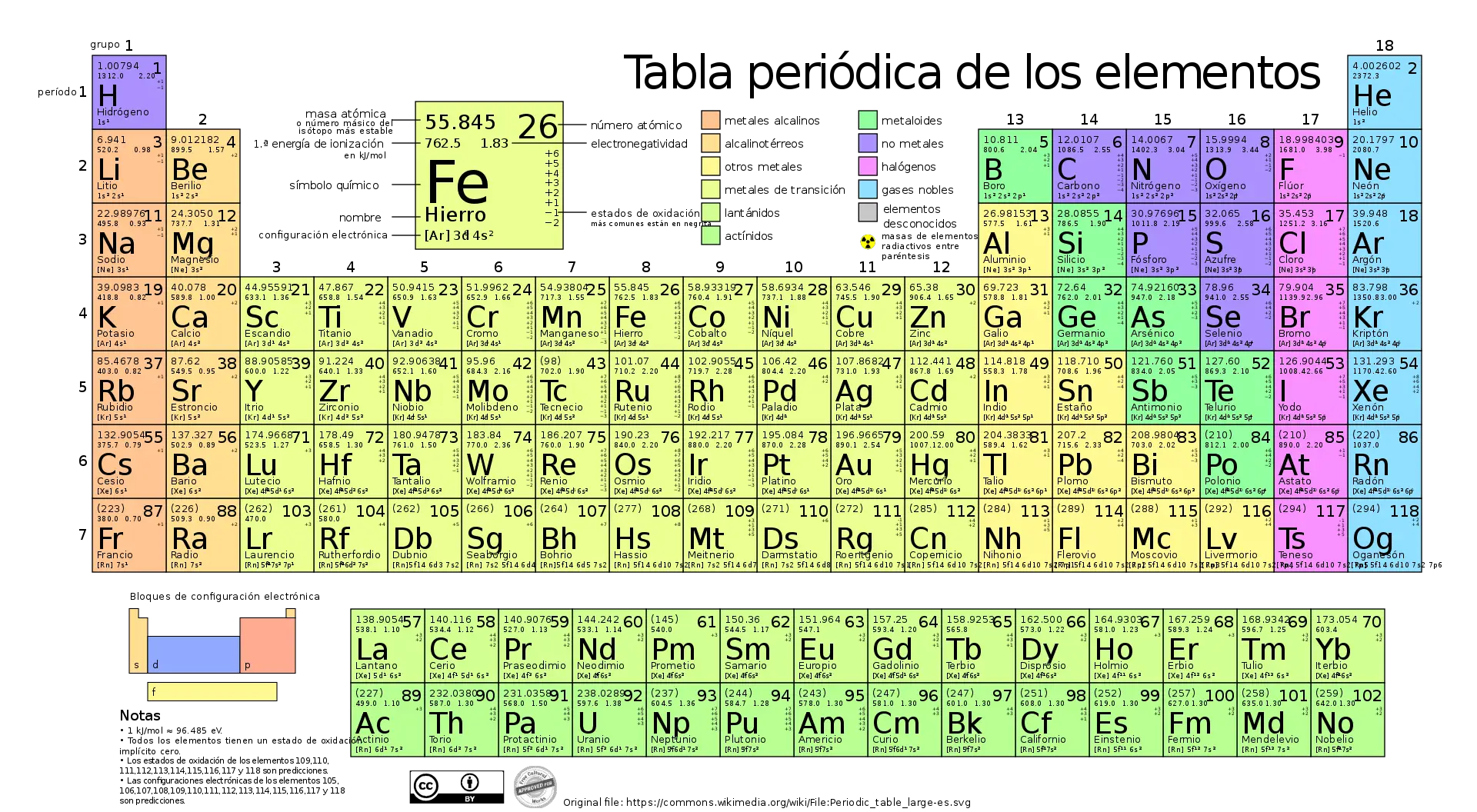 A tabela periódica de elementos químicos é uma ferramenta inestimável para determinar as massas molares de elementos e compostos. Cada elemento da tabela periódica possui uma massa atômica relativa que é arredondada para números inteiros ou frações simples no caso de isótopos.
A tabela periódica de elementos químicos é uma ferramenta inestimável para determinar as massas molares de elementos e compostos. Cada elemento da tabela periódica possui uma massa atômica relativa que é arredondada para números inteiros ou frações simples no caso de isótopos.
Para calcular a massa molar de um composto, basta somar as massas atômicas relativas dos elementos presentes, multiplicadas pelo número de átomos de cada elemento da fórmula.
Exemplo de cloreto de sódio
Um exemplo interessante é o cálculo da massa molar do cloreto de sódio (NaCl).
O sódio (Na) tem uma massa atômica relativa de cerca de 23 u, e o cloro (Cl) tem uma massa atômica relativa de cerca de 35,5 u.
Portanto, a massa molar do NaCl é a soma dessas massas atômicas: 23 amu + 35,5 amu = 58,5 amu, o que equivale a 58,5 g/mol.
Não deve ser confundido com...
A massa molar é frequentemente confundida com outros conceitos de química e física porque todos estão relacionados ao peso ou quantidade de uma substância. Aqui estão alguns conceitos que são comumente confundidos com:
- Massa molecular : Massa molecular é a soma das massas atômicas dos átomos de uma molécula, igual à massa molar, mas expressa em unidades de massa atômica (uma ou ou) , não em g/mol. A massa molar e a massa molecular têm o mesmo valor numérico, mas diferem em suas unidades e no contexto em que são utilizadas.
- Massa atômica : É a massa média dos átomos de um elemento, levando em consideração a abundância de seus isótopos, e é medida em unidades de massa atômica (u). A massa atômica é usada para calcular a massa molar de um elemento no contexto de uma substância.
- Peso molecular : Este termo era usado antigamente como sinônimo de massa molecular, mas não é correto. O peso é uma força (o resultado da ação da gravidade sobre uma massa) e é medido em newtons (N), enquanto a massa molecular é uma medida da quantidade de matéria em unidades de massa atômica. É mais correto falar em massa molecular do que em peso molecular.
- Quantidade de substância (mol) : Às vezes confundida com massa molar porque ambos os conceitos envolvem o mol. No entanto, a quantidade de substância (mol) é uma medida do número de partículas (átomos, moléculas, íons) em uma amostra e não de sua massa. A massa molar, por outro lado, representa a massa de um mol dessas partículas.
- Volume molar : Este conceito refere-se ao volume ocupado por um mol de uma substância, especialmente no contexto de gases, e geralmente é expresso em L/mol. É diferente da massa molar, que mede a quantidade de massa em gramas por mol de substância.
