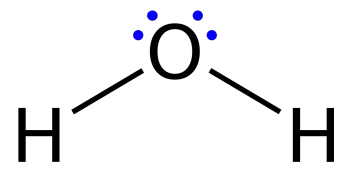
As estruturas de Lewis, também chamadas de diagramas de pontos ou modelos de Lewis, são diagramas que mostram a ligação entre os átomos de uma molécula junto com os pares de elétrons existentes. Uma estrutura de Lewis pode ser desenhada para cada molécula ligada covalentemente, bem como para compostos de coordenação.
As estruturas de Lewis são nomeadas em homenagem a Gilbert Newton Lewis , que as introduziu em 1916.
Os diagramas usados para representar uma configuração eletrônica pontilhada onde os elétrons de valência em pares isolados são representados por pontos são semelhantes, mas também podem conter linhas que representam pares compartilhados em uma ligação química (simples, dupla, tripla, etc.).
Linhas são desenhadas entre átomos ligados (pares de pontos também podem ser usados). Os elétrons em excesso que formam pares solitários são representados por pares de pontos colocados ao lado dos átomos.
Para que serve a estrutura de Lewis?
Uma estrutura de Lewis é uma representação gráfica que mostra a geometria molecular de um composto, as ligações que se formam entre as moléculas e a distância entre elas. Ou seja, essas estruturas mostram cada átomo e sua posição na estrutura da molécula usando seu símbolo químico.
Os modelos de Lewis servem para representar o número de elétrons de valência de um elemento que interage com outros elementos químicos da mesma ou de outra espécie, formando ligações.
Como um gráfico de pontos de Lewis é construído?
Para representar a estrutura de Lewis de uma molécula, é preciso apresentar um átomo central. Os outros elementos que compõem a molécula são representados em torno do átomo central.
O átomo central, se possível, deve ser o menos eletronegativo, por exemplo o carbono. Por outro lado, o hidrogênio é sempre representado como um átomo terminal.
A regra do octeto
A regra do octeto é uma regra que afirma que os átomos se ligam uns aos outros para completar sua última camada de configuração eletrônica.
Esta regra determina que átomos estáveis tenham oito elétrons em sua camada de valência.
Para alcançar essa estabilidade, cada átomo precisa compartilhar, perder ou ganhar elétrons nas ligações químicas que forma até que tenha os oito elétrons necessários na camada de valência.
Ao desenhar um diagrama, evitaremos atribuir mais de oito elétrons a cada elemento porque cada ligação covalente simples contribui com dois elétrons para cada átomo na ligação.
Elétrons de valência
O número total de elétrons representados no modelo de Lewis corresponde à soma dos números de elétrons de valência em cada átomo individual. Em contraste, os elétrons solitários de não valência não são representados.
A valência que está representada na estrutura de Lewis é o número de elétrons no último nível de energia de cada elemento químico ao fazer sua configuração eletrônica.
Uma vez determinados os elétrons de valência, eles devem ser localizados no diagrama. Então, quando todos os pares de elétrons solitários tiverem sido colocados, os átomos podem não obedecer à regra do octeto.
Todos os átomos em um diagrama devem estar ligados. Em uma estrutura de Lewis, consideramos um par de elétrons para formar uma ligação entre dois átomos. Assim como consideramos que dois átomos compartilham o mesmo par de ligação, o átomo que originalmente tinha o par solitário ainda possui um octeto.
