Um próton é uma partícula subatômica com carga elétrica positiva encontrada dentro do núcleo atômico dos átomos. O número de prótons no núcleo atômico é aquele que determina o número atômico de um elemento que é indicado na tabela periódica dos elementos.
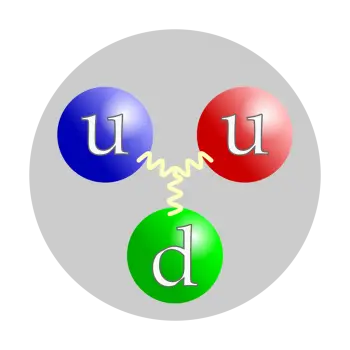
O próton não é uma partícula elementar, mas uma partícula composta. É composto de três partículas ligadas ao glúon, dois quarks up e um quark down. Essa estrutura significa que é um bárion (um subtipo de partículas chamadas hádrons).
Essas subpartículas atômicas estão presentes nos núcleos atômicos, geralmente ligados aos nêutrons por uma forte força nuclear. Por ser uma das partículas subatômicas que fazem parte do núcleo, é um núcleon. A única exceção em que forma um núcleo atômico sem nêutrons é o núcleo do hidrogênio comum.
Os prótons livres podem existir nos plasmas (o quarto estado de agregação da matéria), nos raios cósmicos e no vento solar (fluxo de partículas carregadas liberadas da atmosfera solar).
A vida de um próton é de aproximadamente 10 35 anos, por isso é considerada eterna em um nível experimental. Do ponto de vista do modelo padrão da física de partículas, elas são partículas estáveis. As leis da física não permitem que um nucleon se decomponha espontaneamente devido à preservação do número de bárions.
Qual é a massa de um próton?
Um próton tem uma massa de cerca de 1.674 x 10 -24 g.
Esse valor é quase a mesma massa dos nêutrons. Em comparação com o elétron, a massa do próton é cerca de 1.836 vezes maior.
Qual é a carga elétrica de um próton?
O próton tem uma carga elementar positivo de 1,602 x 10 -19 coulombs. Exatamente a mesma carga absoluta do elétron, mas com o sinal oposto.
Por que os prótons são importantes?
Os prótons são importantes porque definem de que elemento é um átomo.
O número atômico (Z) de um átomo é o número de prótons em seu núcleo e determina as propriedades químicas do átomo.
Para determinar os isótopos de um elemento, o número de nêutrons (N) também é usado somando todos os nucleons e é conhecido como número de massa (A).
Outra característica importante é que sua carga positiva ajuda a capturar elétrons e mantê-los orbitando ao redor do núcleo do átomo.
Quem descobriu o próton?
O próton foi descoberto por Ernest Rutherford em 1919.

A história de sua descoberta remonta a 1886, quando Eugene Goldstein descobriu os raios anódicos e mostrou que eles eram partículas carregadas positivamente (íons) produzidas a partir de gases.
Com seus experimentos, Goldstein observou que essas partículas tinham diferentes valores da relação entre carga e massa. Por esse motivo, a carga positiva com uma partícula não pôde ser identificada.
Em 1911, Ernest Rutherford apresentou seu modelo atômico planetário. Nesse modelo ele já estabeleceu que no centro do átomo se concentrava uma carga elétrica positiva circundada pelos elétrons descobertos por Thompson com carga negativa.
Rutherford libertou o núcleo de hidrogênio usando uma fonte de radioatividade para produzir partículas alfa energéticas. Com sua pesquisa, Rutherford mostrou que o núcleo de hidrogênio estava presente em outros núcleos.
O hidrogênio é o único elemento da tabela periódica que possui um único próton, portanto, ao se referir a um núcleo de hidrogênio, era como falar de um próton.
