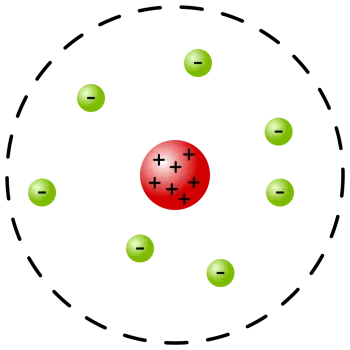
O modelo atômico de Rutherford ou modelo atômico planetário é um modelo do átomo proposto por Ernest Rutherford.
Em 1909, o experimento Geiger e Marsden foi realizado, também conhecido como o experimento Rutherford, pois foi liderado pelo próprio Rutherford. Os resultados do experimento foram publicados em uma análise de 1911 por Rutherford. O espalhamento de Rutherford observado no experimento sugeriu que os primeiros modelos atômicos "Panetone" e "Saturniano" estavam incorretos.
O novo modelo proposto por Rutherford apresentava características que foram mantidas até mesmo em modelos posteriores, tais como:
-
A concentração da maior parte da matéria em um pequeno volume em relação ao tamanho atômico, ou seja, um núcleo atômico
-
A presença de elétrons que giram em torno do núcleo atômico.
Rutherford nada disse sobre a possível movimentação dos elétrons, também porque sabia que sua revolução em torno do núcleo central causaria a emissão de ondas eletromagnéticas.
No entanto, a partir de sua descrição, ele passou a representar o átomo com o núcleo no centro e os elétrons em órbita ao seu redor, como os planetas do sistema solar ao redor do Sol. Devido a essa representação particular, tornou-se conhecido como modelo. .
Quais são os pontos fundamentais do modelo de Rutherford?
-
O átomo é principalmente um espaço vazio. Rutherford negou o modelo atômico de Thomson ao confirmar a existência do núcleo atômico, já postulado por Nagaoka. No entanto, Ruthenford apontou que o núcleo do átomo é muito pequeno em comparação com o próprio átomo.
-
No núcleo do átomo, a massa e a carga positiva do átomo estavam concentradas. Esta característica equilibrou a carga elétrica dos elétrons, tornando-os eletricamente neutros. Rutherford introduziu o conceito de peso atômico, que havia sido omitido anteriormente. A carga nuclear foi identificada como responsável pelo espalhamento das partículas alfa.
-
Os elétrons carregados negativamente presentes ao redor do átomo não afetam o espalhamento das partículas alfa.
Como foi o experimento de Ernest Rutherford?
Em 1911, Rutherford propôs seu modelo de estrutura atômica para explicar os resultados da experiência anterior de Geiger e Marsden, que indicava a presença de uma concentração de carga positiva no centro do átomo: o núcleo atômico.
No entanto, em seu trabalho, Rutherford propôs a passagem de uma partícula α de alta velocidade através de um átomo de uma folha de ouro que tem uma carga central positiva, enquanto rodeada por uma carga de elétrons de magnitude igual.
A partir de considerações energéticas, Rutherford deduziu que o raio da carga central dos átomos em uma série de folhas finas de ouro, que foram o alvo da radiação no experimento Geiger e Marsden, deve ter sido inferior a 3,4 x 10-14 m. Por outro lado, o raio atômico do ouro era conhecido por ser da ordem de 10-10 m.
Rutherford concluiu que, portanto, a carga deve ser concentrada em um volume muito pequeno em relação ao tamanho atômico. Em 1913, Henry Moseley mostrou que a carga nuclear era muito semelhante ao número atômico e mais tarde Antonius van den Broek sugeriu que o número atômico correspondia à carga nuclear.
Rutherford não atribuiu nenhuma estrutura às órbitas dos elétrons, no entanto, ele mencionou o modelo atômico Hantarō Nagaoka, no qual os elétrons estavam dispostos em anéis, mostrando que eles não seriam estáveis.
