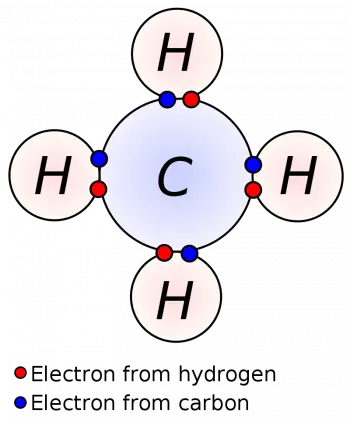
O modelo atômico de Lewis, também conhecido como estrutura de Lewis, é um método usado para representar a distribuição de elétrons em um átomo ou molécula. Foi proposto pelo químico americano Gilbert N. Lewis em 1916.
De acordo com o modelo de Lewis, os átomos são constituídos por um núcleo central que contém prótons e nêutrons, e os elétrons são distribuídos em níveis de energia ou camadas de elétrons ao redor do núcleo. A camada mais interna, mais próxima do núcleo, pode conter até 2 elétrons, enquanto as camadas externas podem conter mais.
Na representação de Lewis, pontos ou símbolos são usados para representar elétrons. Os elétrons de valência, que são os elétrons na camada mais externa do átomo, são representados como pontos ao redor do símbolo do elemento químico. Um máximo de dois pontos são colocados em cada lado (superior, inferior, esquerdo e direito) antes que os pontos adicionais sejam combinados.
Essa concepção da estrutura atômica foi um avanço significativo, pois forneceu uma maneira visual simplificada de representar a estrutura eletrônica dos átomos e a formação de ligações químicas.
Embora tenha sido complementado e ampliado por teorias mais avançadas, continua sendo uma ferramenta valiosa em química para entender a distribuição de elétrons e as interações entre átomos em moléculas.
Contexto histórico dos modelos atômicos
Antes do modelo de Lewis, havia outros modelos atômicos importantes, como o modelo de Thomson, o modelo de Rutherford e o modelo de Bohr.
Cada um desses modelos forneceu novos insights e insights sobre a natureza dos átomos, mas também tinha limitações que não podiam explicar completamente certos fenômenos observados.
O modelo de Thomson, proposto no final do século 19, descrevia o átomo como uma esfera positiva com elétrons embutidos nela, semelhante a um "pudim de passas". No entanto, este modelo não poderia explicar a estabilidade dos átomos ou a distribuição de elétrons.
Posteriormente, o modelo de Rutherford, proposto em 1911, sugeria que os átomos tinham um núcleo central denso e carregado positivamente, enquanto os elétrons orbitavam em torno desse núcleo. Embora esse modelo explicasse melhor a estabilidade dos átomos, ainda não fornecia uma descrição completa de como os elétrons estavam distribuídos em suas órbitas.
Foi então que Gilbert N. Lewis propôs seu modelo atômico em 1916, conhecido como modelo de Lewis. Este modelo se concentrou na distribuição de elétrons de valência, que são os elétrons na camada mais externa dos átomos.
Lewis propôs que os elétrons de valência eram distribuídos em pares ao redor do átomo, e que os átomos interagiam uns com os outros compartilhando ou transferindo elétrons para alcançar uma configuração estável.
Para que serve o modelo de Lewis?
O modelo de Lewis é uma ferramenta fundamental em química e tem vários usos importantes:
-
Representação da estrutura eletrônica: O modelo de Lewis permite uma visualização clara e concisa da distribuição de elétrons em átomos, moléculas e íons. Ajuda a entender a configuração eletrônica dos átomos e a localização dos elétrons nas diferentes camadas eletrônicas.
-
Previsão da formação de ligações: O modelo permite prever como os átomos se ligam uns aos outros para formar ligações químicas. Representa o compartilhamento ou transferência de elétrons entre os átomos para alcançar uma configuração eletrônica mais estável.
-
Identificação de elétrons de valência: Os elétrons de valência são os elétrons na camada mais externa de um átomo e desempenham um papel crucial nas reações químicas. A concepção desse modelo ajuda a identificar os elétrons de valência e entender como eles interagem com outros átomos.
-
Representação de moléculas: O modelo de Lewis é usado para representar a estrutura molecular de compostos químicos. Ajuda a visualizar o arranjo dos átomos e as ligações químicas em uma molécula.
-
Previsão de geometria molecular: fornece informações sobre a distribuição de elétrons e pode ser usada para prever a geometria molecular. Isso é importante para entender as propriedades físicas e químicas das moléculas, bem como sua atividade biológica.
-
Interpretação de Reações Químicas: Este modelo atômico facilita a interpretação de reações químicas, mostrando como átomos e elétrons estão envolvidos em mudanças químicas.
