Em 1904, Joseph John Thomson propôs uma evolução do modelo atômico de Dalton, dando origem ao famoso modelo Thomson, uma teoria revolucionária que tentava explicar duas propriedades fundamentais dos átomos da época.
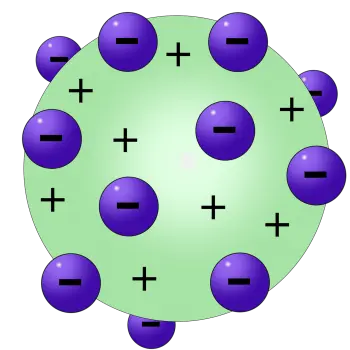
Neste modelo, Thomson postulou que os elétrons, partículas carregadas negativamente, estavam dispersos em um fundo carregado positivamente, criando uma estrutura que lembrava uma sobremesa britânica conhecida como “pudim de ameixa”. Esse curioso apelido vem da analogia visual dos elétrons (as “passas”) espalhados sobre um fundo positivo (o “pudim”).
Esta nova teoria atômica de Thomson tentou explicar duas propriedades então conhecidas dos átomos:
- Os elétrons são partículas carregadas negativamente.
- Os átomos não possuem carga elétrica neutra.
Postulados de Thomson
O modelo atômico de JJ Thomson introduziu vários postulados importantes que procuravam explicar as propriedades observadas dos átomos na época. Aqui estão os postulados fundamentais e suas características:
- Elétrons como partículas subatômicas: Thomson postulou a existência de partículas subatômicas com carga negativa, que mais tarde foram identificadas como elétrons. Este foi um avanço importante, pois até então os átomos eram considerados indivisíveis segundo o modelo atômico de Dalton.
- Estrutura esférica do átomo: Thomson imaginou o átomo como uma esfera uniforme e carregada positivamente, onde os elétrons carregados negativamente estavam embutidos como passas em um pudim. Este conceito de estrutura esférica contrastava com a ideia anterior de Dalton de átomos indivisíveis.
- Distribuição uniforme de elétrons: De acordo com o modelo de Thomson, os elétrons estavam distribuídos uniformemente por toda a esfera carregada positivamente. Este arranjo procurou explicar a neutralidade elétrica do átomo como um todo.
- Livre movimento de elétrons: De acordo com este postulado, os elétrons eram considerados capazes de se mover livremente dentro da esfera carregada positivamente, o que explicava a estabilidade do átomo. Thomson sugeriu que as forças de atração entre os elétrons e a carga positiva circundante eram responsáveis por manter os elétrons em suas órbitas.
- Explicação dos espectros de linha: Thomson propôs que os elétrons giravam livremente em órbitas anulares dentro do átomo. Diferenças nas energias desses níveis orbitais explicariam os espectros de linha observados na emissão de luz quando os elétrons saltavam entre essas órbitas.
Por que é conhecido como modelo do pudim de ameixa?
 O modelo de Thomson tem sido comumente comparado à sobremesa britânica conhecida como pudim de ameixa, o que lhe valeu seu nome característico. Embora Thomson não tenha descrito desta forma, a analogia foi adotada por outros para melhor ilustrar sua ideia.
O modelo de Thomson tem sido comumente comparado à sobremesa britânica conhecida como pudim de ameixa, o que lhe valeu seu nome característico. Embora Thomson não tenha descrito desta forma, a analogia foi adotada por outros para melhor ilustrar sua ideia.
Neste modelo, os elétrons carregados negativamente são distribuídos como se fossem “passas” embutidas em uma massa carregada positivamente, que representa o “pudim”. Desta forma, a carga positiva equilibra a carga negativa dos elétrons, mantendo o átomo como um todo eletricamente neutro. Esta representação simples, embora agora obsoleta, ajudou a visualizar como as partículas subatômicas poderiam coexistir em um espaço relativamente pequeno, antes que detalhes mais precisos sobre a estrutura do átomo fossem conhecidos.
Características do modelo atômico de Thomson
De acordo com o modelo atômico de Thomson, o átomo consiste em elétrons colocados em uma “sopa” carregada positivamente, que compensa as cargas eletricamente negativas dos elétrons.
De acordo com este modelo, os elétrons poderiam girar livremente em uma gota ou nuvem de uma substância com carga positiva. Suas órbitas foram estabilizadas dentro do átomo pelo fato de que quando um elétron se afasta do centro de uma nuvem carregada positivamente, ele experimenta um aumento na força de atração em direção ao centro da nuvem.
Essa força de atração o traz de volta ao centro. A força de atração ao centro de uma nuvem esférica uniformemente carregada é diretamente proporcional à distância ao seu centro.
No modelo de Thomson, os elétrons podem girar livremente em órbitas em anel, que são estabilizadas pelas interações entre os elétrons. Os espectros de linha foram explicados pela diferença de energias ao se mover ao longo de diferentes órbitas de anéis.
O modelo de Thomson tornou-se o precursor do posterior modelo atômico de Bohr, que representa o átomo como uma semelhança do sistema solar .
Limitações do modelo
O modelo do átomo de Thomson foi refutado em um experimento sobre a dispersão de partículas alfa em folha de ouro em 1909, que foi analisado por Ernest Rutherford em 1911. O experimento de Rutherford sugeriu que o átomo tinha um núcleo muito pequeno contendo uma grande carga positiva.
Em 1913, Henry Moseley demonstrou experimentalmente que a carga nuclear nas cargas elementares está muito próxima do número atômico.
Este trabalho acabou por levar à criação, no mesmo ano, do modelo Bohr, semelhante ao sistema solar. De acordo com este modelo, o núcleo tem carga positiva igual ao número atômico e está rodeado por igual número de elétrons em camadas orbitais.
O problema de Thomson
Ao considerar o modelo de Thomson, foi formulado um problema de física matemática ainda não resolvido - encontrar a configuração de muitas cargas com a menor energia potencial em uma esfera - o problema de Thomson.
Legado Thomson
O legado de JJ Thomson na física e na química é inegável, não apenas pela descoberta do elétron, mas também por revolucionar a forma como pensamos sobre os átomos. Embora o modelo do “pudim de ameixa” tenha sido eventualmente substituído, ele representou um passo crucial em direção à compreensão moderna do assunto. Thomson desafiou a noção de que os átomos eram indivisíveis com seus postulados e abriu as portas para uma era de pesquisa subatômica.
Na minha opinião, o que há de mais admirável no trabalho de Thomson é a sua capacidade de ver além das ideias aceites e de propor algo completamente novo, o que requer uma coragem intelectual notável. Seu modelo, embora simples comparado aos avanços posteriores, foi fundamental no desenvolvimento da física moderna. É um lembrete de que cada teoria, mesmo que refinada ou descartada ao longo do tempo, pode ser a centelha que impulsiona o próximo grande avanço científico.
Nesse sentido, o legado de Thomson reside não apenas no seu modelo atômico, mas na sua capacidade de questionar o estabelecido e promover uma nova forma de pensar sobre a natureza da matéria. Sem o seu trabalho, a compreensão atual do átomo não teria sido possível.
