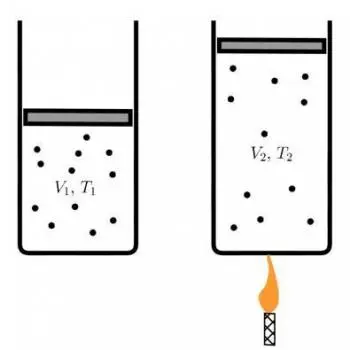
A lei de Charles, também conhecida como lei dos volumes, é um dos princípios fundamentais da termodinâmica dos gases.
Esta lei, em homenagem ao cientista francês Jacques Charles, estabelece uma relação crucial entre o volume de um gás e a sua temperatura em graus Celsius (°C) a pressão constante.
Fórmula da lei de Charles
A formulação da lei de Charles responde à seguinte equação:
V1 / T1=V2 / T2
Onde:
- V 1 é o volume inicial do gás.
- T 1 é a temperatura inicial em graus Celsius (°C).
- V 2 é o volume final do gás.
- T 2 é a temperatura final em graus Celsius (°C).
Esta equação estabelece que a relação entre o volume e a temperatura de um gás, a pressão constante, é uma relação diretamente proporcional. Quando a temperatura aumenta, o volume também aumenta, e quando a temperatura diminui, o volume do gás diminui, desde que a pressão permaneça constante.
História e contexto da lei
 A Lei de Charles é o resultado dos avanços na compreensão dos gases ocorridos no século XVIII. Antes da formulação desta lei, cientistas como Robert Boyle estabeleceram a lei de Boyle-Mariotte, que descreve a relação entre o volume e a pressão de um gás a temperatura constante.
A Lei de Charles é o resultado dos avanços na compreensão dos gases ocorridos no século XVIII. Antes da formulação desta lei, cientistas como Robert Boyle estabeleceram a lei de Boyle-Mariotte, que descreve a relação entre o volume e a pressão de um gás a temperatura constante.
Ao mesmo tempo, Joseph Black observou que a temperatura estava relacionada com o volume de um gás, embora não tivesse formulado uma lei específica para esta relação.
O trabalho de Jacques Charles, um cientista francês, foi essencial para consolidar esta relação. Em 1787, Charles conduziu uma série de experimentos que levaram à formulação de sua lei.
A sua observação fundamental foi que, a pressão constante, o volume de um gás aumenta proporcionalmente à sua temperatura em graus Celsius. Isto significa que se a temperatura de um gás duplicar, o seu volume também duplica, desde que a pressão permaneça constante.
Importância na termodinâmica dos gases
A lei de Charles é fundamental na termodinâmica dos gases e tem várias implicações importantes das quais destacamos duas:
-
Equação dos gases ideais: A Lei de Charles é uma das equações que compõem a equação geral dos gases ideais. Esta equação, PV=nRT, relaciona a pressão (P), o volume (V), a quantidade de substância (n) e a temperatura (T) de um gás ideal. A relação entre volume e temperatura a pressão constante é um componente chave desta equação.
-
Comportamento dos gases: A lei ajuda a compreender como os gases se comportam em resposta às mudanças de temperatura. Esse entendimento é essencial em diversas aplicações, como produção de energia, química industrial e engenharia.
Exemplos de aplicações práticas
 A lei de Charles tem uma ampla gama de aplicações práticas na vida cotidiana e em diversos setores.
A lei de Charles tem uma ampla gama de aplicações práticas na vida cotidiana e em diversos setores.
Alguns exemplos dessas aplicações incluem:
-
Refrigeração e ar condicionado: Os sistemas de refrigeração e ar condicionado baseiam-se no princípio de que quando um gás é comprimido, a sua temperatura aumenta, e quando é expandido, a sua temperatura diminui. Isto permite a regulação da temperatura em espaços fechados.
-
Balões de ar quente: Os balões de ar quente são cheios de ar quente. Quando o ar do balão é aquecido, seu volume aumenta, permitindo que suba de acordo com o princípio de Arquimedes. Jacques Charles quebrou precisamente o recorde de voar em um balão de ar quente.
-
Processos de fabricação: Na indústria, são utilizados fornos e reatores como os utilizados em usinas nucleares que envolvem vapor d'água e outros gases. Compreender a relação entre volume e temperatura é essencial na produção de produtos químicos, metais e outros materiais.
-
Segurança na indústria: A lei de Charles também é importante na segurança industrial. Compreender como as mudanças de temperatura afetam o volume dos gases é essencial para evitar situações perigosas em plantas químicas e processos industriais.
Conclusão
A lei de Charles, formulada por Jacques Charles no século 18, desempenha um papel crucial na termodinâmica dos gases. Esta lei estabelece uma relação diretamente proporcional entre o volume e a temperatura de um gás a pressão constante.
A sua importância reflecte-se numa vasta gama de aplicações práticas, desde sistemas de refrigeração e aquecimento até à produção industrial e segurança no manuseamento de gases.
O trabalho de Charles é uma prova da importância das leis fundamentais na compreensão e aplicação de princípios científicos na vida cotidiana e em vários setores.
