
O átomo é uma estrutura na qual a matéria é organizada no mundo físico ou na natureza. Sua estrutura é composta por diferentes combinações de três subpartículas: nêutrons, prótons e elétrons.
Definição de átomo: "É a menor partícula da qual um elemento pode ser feito e as moléculas são formadas por meio de sua combinação."
Essa definição vem do grego, que significa indivisível. Na época em que essas partículas foram nomeadas, acreditava-se que elas não poderiam ser divididas.
Estrutura atômica, as partes de um átomo
O átomo, de acordo com o modelo atômico atual, é dividido em duas partes:
-
O núcleo: esta parte é composta por nêutrons e prótons.
-
A crosta: formada apenas por elétrons.
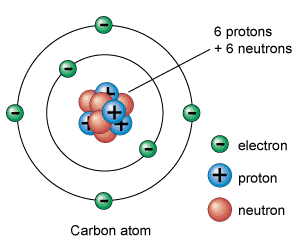
Partículas subatômicas: prótons, nêutrons e elétrons
Prótons, nêutrons e elétrons são as partículas subatômicas que compõem os átomos. A forma como se organizam entre si é o que define cada elemento químico.
Os elétrons são as partículas subatômicas mais leves e têm uma carga elétrica negativa. Os prótons são carregados positivamente e pesam cerca de 1.836 vezes mais que os elétrons. Finalmente, os nêutrons não têm carga elétrica e pesam aproximadamente o mesmo que os prótons.
Prótons e nêutrons são agrupados no núcleo atômico (por isso também são chamados de núcleons) graças às forças nucleares que os mantêm unidos. Portanto, o núcleo atômico tem uma carga positiva (a dos prótons) na qual se concentra quase toda a sua massa.
Por outro lado, ao redor do núcleo existe um certo número de elétrons, carregados negativamente. A carga total do núcleo (positiva) é igual à carga negativa dos elétrons, portanto a carga elétrica total é neutra.
Como foi descoberto o modelo atômico atual?
Antes de chegar ao conhecimento atual sobre a estrutura do átomo, diferentes teorias atômicas sobre a composição da matéria foram desenvolvidas ao longo da história.
Com base nas teorias atômicas, os cientistas vêm apresentando modelos atômicos que evoluíram gradativamente.
O primeiro modelo apresentado por John Dalton evoluiu até chegar ao modelo atômico de Niels Bohr. Bohr apresentou um modelo muito semelhante ao atual com os elétrons girando em torno do núcleo.
características dos átomos
Dependendo da composição dos átomos, os diferentes elementos químicos representados na tabela periódica de elementos químicos são diferenciados.
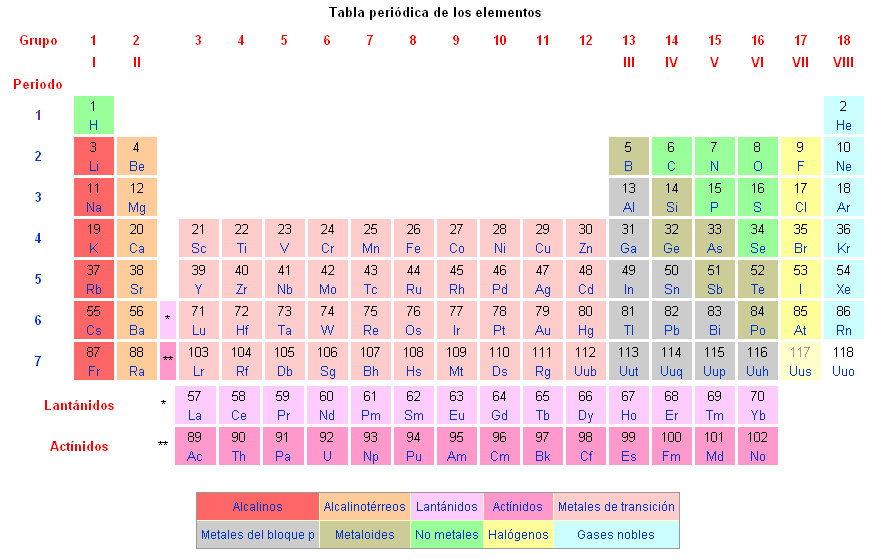 As propriedades que definem os átomos são:
As propriedades que definem os átomos são:
-
O número atômico (Z) indica o número de prótons no núcleo. Todos os átomos com o mesmo número de prótons pertencem ao mesmo elemento. Por exemplo, aqueles com apenas um próton são átomos de hidrogênio.
-
O número de massa refere-se à soma de prótons e nêutrons. Elementos com diferentes números de nêutrons pertencem a diferentes isótopos do mesmo elemento.
-
Eletronegatividade é a tendência que um átomo tem de atrair elétrons ao formar uma ligação química.
-
O raio atômico corresponde à metade da distância entre dois núcleos do mesmo elemento ligados entre si.
-
O potencial de ionização é a energia necessária para separar um elétron do elemento.
Relação dos átomos com as moléculas
Uma molécula é formada quando dois ou mais átomos são unidos por ligações químicas. Os átomos podem ser unidos por ligações. Essas ligações são formadas quando os átomos compartilham, ganham ou perdem elétrons para alcançar uma configuração eletrônica mais estável.
Em uma molécula, os átomos estão arranjados em uma estrutura tridimensional e são mantidos juntos por ligações químicas. A maneira como os átomos se unem em uma molécula determina suas propriedades químicas e físicas, bem como seu comportamento em reações químicas.
De onde vem a energia dos átomos?
A energia dos átomos vem principalmente de duas fontes:
- a energia nuclear
- energia eletrônica.
Energia nuclear
A energia nuclear está relacionada com as forças que mantêm os núcleos atômicos juntos. A energia nuclear é liberada ou absorvida durante processos nucleares, como a fissão nuclear e a fusão nuclear. Na fissão nuclear, um núcleo pesado é dividido em núcleos menores, e na fusão nuclear, dois núcleos leves se juntam para formar um mais pesado. Ambos os processos liberam energia devido a diferenças nas massas dos núcleos envolvidos, segundo a famosa equação de Einstein, E = mc².
Energia eletrônica
Por sua vez, a energia eletrônica está associada à configuração dos elétrons nos átomos. Os elétrons orbitam ao redor do núcleo atômico em níveis de energia ou camadas de elétrons.
Os elétrons podem se mover entre esses níveis de energia absorvendo ou emitindo energia na forma de fótons. Quando os elétrons absorvem energia, eles podem pular para níveis de energia mais altos. Quando eles liberam energia, eles retornam a níveis de energia mais baixos.
Essas mudanças na energia eletrônica são responsáveis pela emissão e absorção da luz, bem como de outras formas de radiação eletromagnética, como os raios X.
