Isótopos são átomos cujos núcleos atômicos têm o mesmo número de prótons, mas um número diferente de nêutrons. Nem todos os átomos do mesmo elemento são idênticos e cada uma dessas variedades corresponde a um isótopo diferente.
A palavra isótopo é usada para indicar que todos os tipos de átomos de um elemento químico estão localizados no mesmo lugar na tabela periódica.
Definição de isótopo
De acordo com a definição de isótopo, cada um do mesmo elemento tem o mesmo número atômico (Z), mas cada um tem um número de massa diferente (A). O número atômico corresponde ao número de prótons no núcleo atômico do átomo. O número de massa corresponde à soma de nêutrons e prótons no núcleo.
Isso significa que os diferentes isótopos do mesmo átomo diferem entre si apenas pelo número de nêutrons.
Embora possam ter qualquer número de nêutrons, existem algumas combinações preferidas de prótons e nêutrons em diferentes átomos.
As que são leves (com poucos prótons e nêutrons) tendem a igualar o número de nêutrons e prótons, enquanto as mais pesadas tendem a ter mais nêutrons do que prótons.
Tipos de isótopos
Os isótopos podem ser classificados em três categorias principais com base em sua estabilidade:
-
Isótopos estáveis: São aqueles que não sofrem decaimento radioativo. Esses isótopos têm uma mistura equilibrada de prótons e nêutrons em seu núcleo, dando-lhes estabilidade a longo prazo. Por exemplo, Carbono-12, Oxigênio-16 ou Cálcio-40.
-
Isótopos instáveis ou radioativos: São aqueles que sofrem decaimento radioativo, emitindo partículas subatômicas ou radiação para atingir uma configuração mais estável. Os isótopos radioativos têm excesso ou falta de nêutrons em comparação com a configuração mais estável. Alguns exemplos são Urânio-238, Plutônio-239 ou Carbono-14.
-
Isótopos semiestáveis ou radioisótopos: são isótopos instáveis, mas com meia-vida longa. Seu decaimento radioativo é mais lento em comparação com outros isótopos radioativos. Potássio-40 e Césio-137 são exemplos desse tipo.
Isótopos instáveis: definição e exemplos
Isótopos instáveis, também conhecidos como radioisótopos, são aqueles isótopos que sofrem decaimento radioativo, emitindo partículas subatômicas ou radiação na tentativa de alcançar uma configuração mais estável.
Esses isótopos têm excesso ou falta de nêutrons em comparação com a configuração mais estável, tornando-os instáveis e propensos ao decaimento nuclear.
Aqui estão alguns exemplos de isótopos instáveis e algumas de suas aplicações:
-
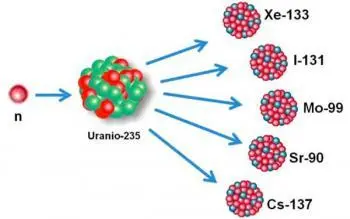
Urânio-238 (238U): É um isótopo instável de urânio e é encontrado naturalmente na crosta terrestre. É o precursor do isótopo radioativo urânio-235, que é usado na produção de energia nuclear e na fabricação de armas nucleares.
-
Plutônio-239 (239Pu): É um isótopo instável do plutônio e é produzido a partir do isótopo urânio-238 em reatores nucleares. É usado na produção de armas nucleares e em reatores de fissão nuclear.
-
Carbono-14 (14C): É um isótopo instável do carbono que se forma na atmosfera devido à interação dos raios cósmicos. É usado na datação por radiocarbono para determinar a idade de objetos arqueológicos e geológicos.
-
Iodo-131 (131I): É um isótopo instável do iodo e é produzido em reatores nucleares. É usado em medicina nuclear para o tratamento de hipertireoidismo e câncer de tireoide, pois emite radiação beta e gama que pode destruir células anormais da tireoide.
-
Césio-137 (137Cs): É um isótopo instável do césio e é formado como subproduto da fissão nuclear. É usado em aplicações industriais, em radioterapia e na medição de atividade sísmica.

Isótopos estáveis: definição e exemplos
Isótopos estáveis são aqueles isótopos que não sofrem decaimento radioativo e mantêm sua composição nuclear ao longo do tempo. Isso significa que eles têm uma mistura equilibrada de prótons e nêutrons em seu núcleo, dando-lhes estabilidade a longo prazo.
Aqui estão alguns exemplos de isótopos estáveis e suas aplicações:
-
Carbono-12 (12C): É o isótopo de carbono mais abundante na Terra. É usado em química orgânica como referência para a determinação de massas moleculares e em espectrometria de massa para calibração de instrumentos.
-
Oxigênio-16 (16O): É o isótopo mais comum de oxigênio e é encontrado na atmosfera, água e minerais. É usado na respiração celular e na formação de ligações químicas em muitas reações biológicas.
-
Hidrogênio-1 (1H): É o isótopo mais comum de hidrogênio e é usado em uma ampla gama de aplicações. É essencial na formação de moléculas biológicas, como a água, e é usado na produção de amônia e outros produtos químicos.
-
Nitrogênio-14 (14N): É o isótopo mais comum de nitrogênio e é encontrado na atmosfera em grandes quantidades. É utilizado na síntese de fertilizantes e em processos de enriquecimento de urânio.
-
Cálcio-40 (40Ca): É o isótopo de cálcio mais abundante na Terra e é encontrado em ossos, dentes e outros tecidos. É essencial para a contração muscular, coagulação do sangue e estrutura óssea.
Isótopos semiestáveis: definição e exemplos
Isótopos semiestáveis, também conhecidos como isótopos de vida longa, são aqueles isótopos que têm uma meia-vida significativamente mais longa em comparação com os isótopos radioativos típicos.
Embora sejam instáveis e eventualmente quebrem, sua meia-vida é longa o suficiente para serem considerados "semi-estáveis".
Alguns exemplos de isótopos semi-estáveis:
-
Potássio-40 (40K): É um isótopo semi-estável de potássio que tem uma meia-vida de aproximadamente 1,3 bilhão de anos. É usado na datação radiométrica de rochas e minerais, especialmente na datação de rochas vulcânicas.
-
Rubídio-87 (87Rb): É um isótopo semi-estável do rubídio com meia-vida de aproximadamente 49 bilhões de anos. É usado na datação radiométrica de minerais e rochas, especialmente na datação de minerais como o feldspato.
-
Samário-147 (147Sm): É um isótopo semi-estável do samário com meia-vida de aproximadamente 106 bilhões de anos. É usado na datação radiométrica de minerais e rochas, especialmente na datação de minerais como a apatita.
-
Urânio-235 (235U): Embora seja considerado um isótopo instável, sua meia-vida de aproximadamente 704 milhões de anos o coloca em uma categoria intermediária. É usado na indústria de energia nuclear como combustível em reatores nucleares e também é importante para a produção de armas nucleares.
Qual é a meia-vida de um isótopo?
A meia-vida de um isótopo é o tempo médio que ele leva para decair para a metade de sua quantidade inicial. É uma medida usada para descrever a estabilidade ou taxa de decaimento de um isótopo radioativo.
Quando um isótopo radioativo decai, ele emite partículas subatômicas ou radiação para atingir uma configuração mais estável. A meia-vida refere-se ao tempo que leva para metade dos átomos de um determinado isótopo decair.
Isótopos de origem natural e artificial
Os isótopos podem ser classificados em duas categorias principais: naturais ou artificiais.
isótopos de ocorrência natural
Isótopos de ocorrência natural são aqueles encontrados na natureza e produzidos naturalmente por meio de processos geológicos, astronômicos e biológicos.
Esses isótopos existem desde a formação da Terra e são encontrados em minerais, água, ar, plantas, animais e organismos vivos.
Alguns exemplos de isótopos de ocorrência natural são:
-
Carbono-12 (12C)
-
Hidrogênio-1 (1H)
-
Oxigênio-16 (16O)
-
Urânio-238 (238U)
-
Potássio-39 (39K)
Isótopos de origem artificial
Isótopos de origem artificial são aqueles produzidos por atividades humanas, seja por meio de reações nucleares em laboratórios ou por radioatividade induzida em reatores nucleares.
Eles geralmente não existem naturalmente em números significativos na Terra. Alguns exemplos de origem artificial são:
-
Plutônio-239 (239Pu)
-
Tecnécio-99m (99mTc)
-
Cobalto-60 (60Co)
-
Iodo-131 (131I)
-
Amerício-241 (241Am)
Os isótopos produzidos pelo homem são usados em uma ampla gama de aplicações, como na medicina nuclear para diagnóstico e tratamento, na indústria para testes não destrutivos, na pesquisa científica e na geração de energia em reatores nucleares.
Além disso, alguns isótopos de origem artificial são utilizados em aplicações militares e na fabricação de armas nucleares.


