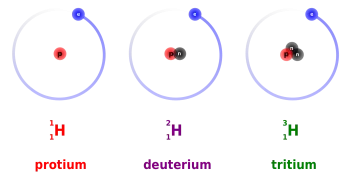
Trítio e deutério são dois dos três isótopos de hidrogênio que são usados como combustível em reações de fusão nuclear. O hidrogênio possui três isótopos: prótio, deutério e trítio.
Uma reação de fusão nuclear consiste na união de dois núcleos leves (átomos de hidrogênio) para formar um único. Isso ocorre quando os núcleos ficam tão próximos que as forças nucleares entre eles se tornam muito fortes.
Este tipo de energia está em fase de estudo e pretende ser uma alternativa aos atuais reatores de fissão nuclear como fonte de energia elétrica. A vantagem dessa tecnologia é que ela produzirá energia praticamente ilimitada, já que deutério e trítio podem ser obtidos a partir do hidrogênio comum. Deve-se lembrar que este elemento químico é encontrado em abundância no ar e na água do mar.
O que é trítio?
O trítio é um isótopo radioativo de hidrogênio cujo núcleo consiste em um próton e dois nêutrons. A aplicação mais importante do trítio é seu uso como combustível nuclear para obtenção de energia através da fusão nuclear.
Geralmente é designado pelo símbolo T, embora deva ser sistematicamente simbolizado como 3H. Foi descoberto em 1934 por Rutherford, Oliphant e Harteck no estudo do bombardeio de deutério com deutérios.
O trítio é um isótopo natural que é gerado pela ação dos raios cósmicos sobre os gases atmosféricos. Por outro lado, esse isótopo pode ser obtido industrialmente pelo bombardeio de lítio com nêutrons de baixa energia.
O trítio tem meia-vida de 12,3 anos e emite radiação beta (β) de energia muito baixa (0,018 MeV), totalmente livre de radiação γ, portanto, praticamente não possui radiotoxicidade.
Efeitos sobre a saúde do trítio
As partículas beta formadas pela reação de decomposição do trítio se espalham no ar apenas 6,0 mm e não conseguem passar nem mesmo pela camada superior da pele humana. No entanto, este isótopo apresenta um risco de radiação quando inalado, absorvido com alimentos e absorvido pela pele.
Para que serve o trítio?
O trítio pode ser usado em diferentes aplicações com diferentes objetivos:
-
Iluminação auto-alimentada: partículas beta emitidas pelo decaimento radioativo de pequenas quantidades de trítio fazem com que substâncias químicas chamadas fósforos brilhem.
-
Armas Nucleares: Este elemento químico é usado para melhorar a eficiência e o desempenho das bombas de fissão nuclear e os estágios de fissão das bombas de hidrogênio em um processo conhecido como reforço.
-
Fusão Nuclear Controlada: O trítio é um combustível importante para a fusão nuclear controlada em projetos de reatores nucleares de confinamento magnético e fusão inercial.
-
Química Analítica: O trítio às vezes é usado como radiomarcador. Tem a vantagem de que quase todos os produtos químicos orgânicos contêm hidrogênio, por isso é fácil encontrar um lugar para colocar o trítio na molécula sob investigação.
O que é deutério?
O deutério (²H) é um isótopo estável de hidrogênio encontrado na natureza com uma proporção de um em 6500 átomos de hidrogênio. O núcleo atômico do deutério é composto por um próton e um nêutron.
O deutério também é conhecido como hidrogênio pesado e é representado pelo símbolo ²H ou como D. Embora seja um átomo de hidrogênio, as propriedades físicas entre o deutério e um átomo de hidrogênio leve são máximas, pois a massa atômica do deutério é o dobro.
A Terra e outras partes do Sistema Solar contêm deutério. A fusão em estrelas tende a destruir o deutério e, por outro lado, não há processos de criação natural conhecidos além da nucleossíntese primordial.
Para que serve o deutério?
O deutério é usado na energia nuclear como combustível em processos de fusão nuclear junto com o trítio. Seu uso é explicado por sua grande seção efetiva da reação.
Por outro lado, em química, esse isótopo de hidrogênio é usado como traçador de isótopos não radioativos em moléculas para estudar mudanças metabólicas e reações químicas porque, do ponto de vista químico, se comporta de maneira semelhante ao hidrogênio comum.


